Karbon elementi insan vücudunda oksijenden bile daha fazla bulunmaktadır. Aynı zamanda vücuttaki ağırlığın yaklaşık olarak %18.5’ini oluşturmaktadırlar. Karbon, doğada saf olarak ya da grafit ve elmas gibi yüksek bir saflık derecesinde bulunabilmektedir. Ayrıca bu element, diğer elementler ile birlikte bileşik halde bulunabilmektedir. Karbon elementi yer kabuğunu yaklaşık olarak %0.2’sini oluşturmaktadır ve dünyada hem doğal hem de diğer elementler ile birlikte bileşik biçimde bulunabilmektedir. Aynı zamanda karbon, oksijen, azot ve hidrojen canlılığını oluşturmakta olan temel elementlerden biridir. Evrende ve dünyada bulunan tüm canlıların bünyesinde karbon elementi bulunmaktadır. Evrende ise karbon %99 oranında karbon-12 ve yaklaşık olarak %1 oranı gibi karbon-13 ve çok küçük oranlarda da karbon-14 olarak bulunmaktadır.
Çeşitli yollar ile birbirlerine bağlanan karbon atomları, bağlanmaları sonucu karbon allotroplarını oluştururlar. Allotrop ise, aynı elementin uzayda farklı bir geometri ile dizilimi sonucunda oluşan formlarına denmektedir. En çok bilinen karbon allotroplar grafit ve elmastır. Aynı element olan karbondan oluşmuş bile olsalar grafit ve elmas, karbondaki farklılıkların olduğu geometrik dizilim nedeni ile bu iki malzeme birbirinden oldukça farklı fiziksel özellikleri bulunmaktadır. Mesela, grafit yumuşak ve siyah iken elmas transparan ve sert bir forma sahiptir. Aynı zamanda elmasa kıyasla grafit daha iyi bir elektrik iletkenidir.
Karbon Elementinin Özellikleri Nelerdir?
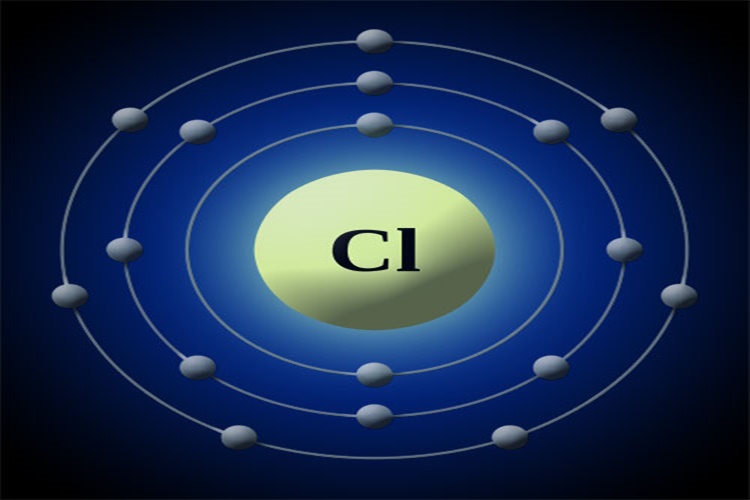
Karbon elementinin simgesi C, atom numarası ise 6’dır. Atom ağırlığı 12,011 olan karbonun periyodik tabloda 14. Grubun silisyum, germanyum, kalay ve kurşun gibi elementler ile birlikte yer almaktadır. Bu elementler ararsındaki en an metaliği ve en hafifi olanıdır. 14. Grup elementler periyodik listede bulunan pek çok grubun aksine birbirlerinden kimyasal açıdan oldukça farklıdırlar. Karbonda grubu temsil eden davranışı sergileyendir.
Doğal karbonun yaklaşık olarak %98,89’unu oluşturan karbon-12, karbonun izotopları arasında en bol bulunanıdır. Bu izotop tam olarak 12 dalton yani atom kütlesi birimi değerindedir ve uluslar arası, atom ağırlığı konusunda standart olarak kullanılır. Karbon-13 doğal karbonun %1,11’ini oluşturur ve ikinci karalı olan izotoptur. Beş radyoaktif izotopu bilinen karbonun izotopu bilinmektedir. Bunlardan en yararlı ve en kararlı olanı ise karbon-14’tür. Serbest karbon atomunun 1s kabuğunda bulunan iki elektron, 2s ve 2p kabuklarında ise bağ oluşturmaya hazır olan dört değerlik elektronu bulunmaktadır. metaller ve ametallerin çoğunluğundan farklı olarak, karbonda bağ oluşumu genel olarak iyonik değil kovalent yani ortaklaşa niteliğindedir. Sebeplerinden biri, atom sayısının karbonda küçük olması nedeniyle atomun çekirdeklerine yakın olan değerlik elektronlarını oldukça sıkı tutmasıdır. Dört elektron alması veya yitirmesi bir karbon atomunun kararlı bir iyon haline gelmesine sebep olur. Bu olay da oldukça büyük bir enerji ister.